RESÚMENES
El ungüento KX2-391 al 1%, un nuevo inhibidor dual de sarcoma/tubulina, es eficaz y seguro en el tratamiento de adultos con queratosis actínica en dos estudios de fase 3
Presentado por: Edward Lain, MD, FAADAustin Institute for Clinical Research Inc., Pflugerville, TX, USA
- El ungüento KX2-391 al 1% es seguro y eficaz en el tratamiento de adultos con queratosis actínica (QA).
- El ungüento KX2-391 al 1% demostró un 100% de eliminación de la QA en al menos el 44% de los pacientes estudiados.
El ungüento KX2-391 al 1%, un nuevo inhibidor dual de sarcoma (Src)/tubulina, demostró ser eficaz en el tratamiento de adultos con queratosis actínica (QA) en dos estudios de fase 3 (KX01-AK-003 y KX01-AK- 004). La principal medida de resultado del estudio consistió en el 100% de aclaramiento de la QA o en el aclaramiento parcial específico de la cara o el cuero cabelludo. El ungüento KX2-391 al 1% demostró un beneficio clínico estadísticamente significativo frente a placebo, con el 44% de los pacientes en KX01-AK-003 y el 54% de los pacientes en KX01-AK-004 reportando un 100% de eliminación de la QA. La principal medida de resultado de seguridad demostraron que los eventos adversos emergentes relacionados con el tratamiento (treatment-related emergent adverse events, TEAE) fueron de leves a moderados.
Evaluar la variable principal de eficacia del 100% de aclaramiento de la QA en el día 57 del estudio, y evaluar la seguridad, las reacciones cutáneas locales (local skin reactions, LSR) y los eventos adversos (EA) del ungüento KX2-391 al 1% versus vehículo en adultos con QA.
Tipo de estudio
- Doble ciego.
- Controlado por vehículo.
- Aleatorizado.
- Grupos paralelos.
- Multicéntrico.
- Fase 3.
Objetivo principal
- Evaluación de la variable principal de resultado de eficacia del 100% de aclaramiento de QA en el día 57 para el ungüento KX2-391 al 1% versus vehículo en adultos con QA.
- Evaluación de la seguridad (reacción cutánea local y EA) del ungüento KX2-391 al 1% en comparación con vehículo en adultos con QA.
Población de pacientes
- Número total de reclutados: 702 sujetos en dos estudios idénticos, que comprendieron 351 pacientes cada uno, localizados en 31 centros, por estudio.
- Población por intención a tratar.
- Edad Media: 69.75 años.
- Sexo: Relación masculino/femenino: de 6.7 a 1.
- Raza: 99.5% blanca.
- Tipo de piel I/II en la escala de Fitzpatrick: 72.75%.
- Número basal mediano de lesiones QA: 6.
- Área de tratamiento, relación cara: cuero cabelludo: 2:1
Medida principal de resultado
- La medida principal de resultado fue el 100% de aclaramiento de la QA en el día 57 dentro del área de 25 cm2 en pacientes adultos con QA que usaron el ungüento KX2-391 1% versus vehículo.
Medida secundaria de resultado
- Evaluación de datos de seguridad específicos para la reacción cutánea local y EA del ungüento KX2-391 al 1% versus vehículo en adultos con QA.
Fármacos/Procedimientos utilizados
- KX2-391 es una molécula pequeña con mecanismos de acción diferenciados, que incluyen la inhibición de la actividad de la quinasa Src y la inhibición de la polimerización de la tubulina que conduce a una regulación positiva de la apoptosis en células en proliferación.
- El área de tratamiento fue de 25 cm2 con 4-8 lesiones típicas visibles de QA en la cara o el cuero cabelludo
- Ungüento KX2-391 al 1% contra vehículo en una proporción de 1:1.
- El tratamiento se realizó una vez al día, durante 5 días consecutivos, aplicado por los participantes en el estudio, y se dejó en el lugar por aproximadamente 12 horas.
- Se logró un cumplimiento terapéutico superior al 99%.
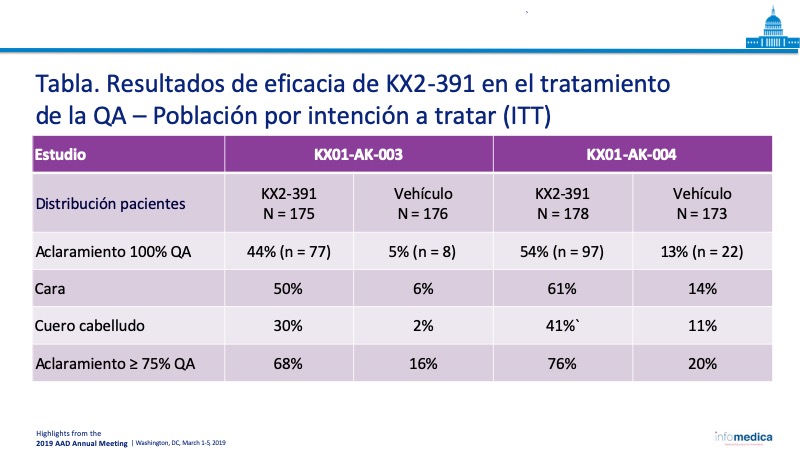
- Las medidas de resultados de eficacia demostraron un efecto estadísticamente significativo del tratamiento con KX2-391 en comparación con el vehículo (Tabla).
- Las medidas de resultado de seguridad demostraron que KX2-391 fue bien tolerado.
- Ninguna exposición ocular provocó eventos adversos oculares.
- No hubo ECG, cambios en los exámenes físicos o signos vitales o hallazgos de laboratorio anormales clínicamente significativos relacionados.
- Todos los EA graves que ocurrieron durante el estudio se consideraron no relacionados con el tratamiento.
- La proporción de TEAE fue de 11-20% en el grupo activo versus 9-11% en el grupo con sólo vehículo.
- La media de la suma de 4 LSR ocurrió en el día 8 y se resolvió en promedio para el día 29, y las ocurrencias de LSR más comunes consistieron en eritema, escamas o descamación.
- Se demostró que el ungüento KX2-391 al 1% es seguro y efectivo en dos ensayos de fase 3 idénticos, alcanzando las tasas más altas de aclaramiento completo de la AK en el día 57, con 44% y 54% de los pacientes logrando un aclaramiento del 100% de la QA.
- Se demostró que las diferencias clínicas fueron estadísticamente significativas para todos los subgrupos analizados, incluido el cuero cabelludo y la cara.
- La mayoría de los TEAE consistieron en prurito o dolor en el sitio de aplicación que fueron de leves a moderados y no requirieron tratamiento.
- El cumplimiento del tratamiento por los participantes en el estudio fue excelente, con > 99% completando la autoaplicación del ungüento durante 5 días.
Mensajes clave/perspectiva clínica
- Se comprobó que el ungüento KX2-391 al 1% es seguro y eficaz para el tratamiento de pacientes adultos con QA.
- Casi la mitad (44% y 54%, respectivamente) experimentaron un aclaramiento de la QA del 100% con una mejora mayor medida en el área facial.
- Los resultados de seguridad indicaron que la mayoría de los TEAE fueron leves a moderados y no requirieron tratamiento.
Presenter disclosure(s): The presenter has reported that he is an investigator for this clinical trial, and that the study is sponsored by Athenex, Inc. The content of the presentation had not been publicly disclosed as of the AAD 2019 presentation, and was provided for research purposes only. Almirall and Athenex are partners in the development program of KX2-391 ointment 1% for actinic keratosis.
Written by: Daniel Bennett, MPH
Reviewed by: Martina Lambertini, MD
RESÚMENES

Bienvenido a los aspectos destacados de la AAD 2019
Prof. Nellie Konnikov, MD, FAADNos complace presentar los aspectos más destacados de la Reunión Anual de la Academia Americana de Dermatología (AAD) de 2019. Nuestra reunión se llevó a cabo del 1 al 5 de marzo de 2019 en Washington, DC. La conferencia de la AAD … [ Leer más ]
 Canada EN
Canada EN Canada FR
Canada FR Deutschland
Deutschland English
English italiano
italiano português
português Taiwan
Taiwan