ZUSAMMENFASSUNGEN
1%ige KX2-391-Salbe – Wirksamkeit und Sicherheit eines neuartigen dualen Sarkom-/Tubulin-Inhibitors für die Behandlung von Erwachsenen mit aktinischer Keratose in zwei Phase-III-Studien bestätigt
Vorgetragen von: Edward Lain, MD, FAADAustin Institute for Clinical Research Inc., Pflugerville, TX, USA
- Die Wirksamkeit und Sicherheit der 1%igen KX2-391-Salbe wurde für die Behandlung von Erwachsenen mit aktinischer Keratose (AK) bestätigt.
- Die 1%ige KX2-391-Salbe führte zu einem 100%igen Abklingen der AK bei mindestens 44 % der untersuchten Patienten.
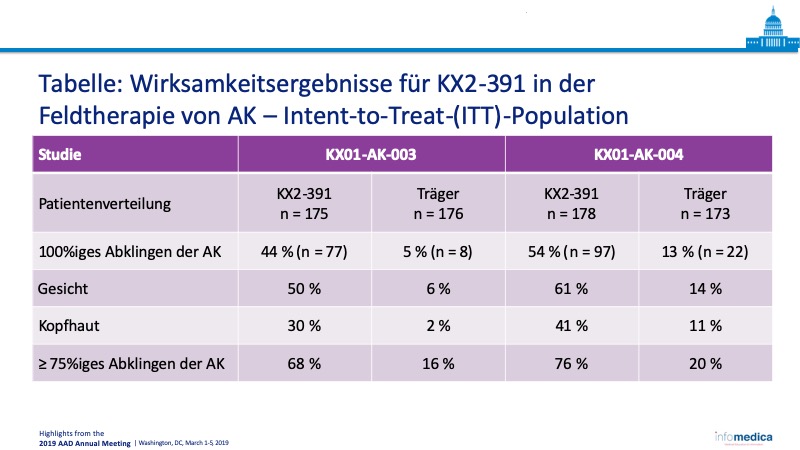
Die Wirksamkeit der 1%igen KX2-391-Salbe, einem neuartigen dualen Sarkom-(Src)-/Tubulin-Inhibitor, konnte in der Behandlung von Erwachsenen mit aktinischer Keratose (AK) in zwei Phase-III-Studien (KX01-AK-003 und KX01-AK-004) nachgewiesen werden. Die primären Ergebnismessgrößen für die Studie waren ein 100%iges Abklingen der AK oder ein partielles Abklingen im Gesicht oder auf der Kopfhaut. Die 1%ige KX2-391-Salbe zeigte im Vergleich zu Placebo mit einem 100%igen Abklingen der AK bei 44 % der KX01-AK-003-Patienten und 54 % der KX01-AK-004-Patienten einen statistisch signifikanten klinischen Nutzen. Entsprechend den Ergebnismessgrößen für die Sicherheitsparameter waren die behandlungsbedingten, während der Behandlung aufgetretenen unerwünschten Ereignisse (TEAEs) leicht bis mittelschwer.
Die Beurteilung des primären Wirksamkeitsendpunkts des 100%igen Abklingens der AK nach 57 Tagen sowie die Beurteilung der Sicherheit, der lokalen Hautreaktionen (LSRs) und der unerwünschten Ereignisse (AEs) der 1%igen KX2-391-Salbe im Vergleich zur Trägersubstanz bei Erwachsenen mit AK.
Art der Studie
- Doppelblind.
- Trägerkontrolliert.
- Randomisiert.
- Parallelgruppe.
- Multizentrisch.
- Phase III.
Hauptziel
- Die Beurteilung des primären Wirksamkeitsendpunkts des 100%igen Abklingens der AK nach 57 Tagen mit der 1%igen KX2-391-Salbe im Vergleich zur Trägersubstanz bei Erwachsenen mit AK.
- Die Beurteilung der Sicherheit (lokale Hautreaktionen und AEs) der 1%igen KX2-391-Salbe im Vergleich zur Trägersubstanz bei Erwachsenen mit AK.
Patientenpopulationen
- Anzahl der Teilnehmer insgesamt: 702 Teilnehmer in zwei identischen Studien mit jeweils 351 Patienten in jeweils 31 Prüfzentren pro Studie.
- Intent-to-Treat-Population.
- Medianes Alter: 69,75 Jahre.
- Geschlecht: Verhältnis Männer/Frauen von 6,7 zu 1.
- Ethnische Zugehörigkeit: 99,5 % hellhäutig.
- Zusammensetzung des Hauttyps I/II nach Fitzpatrick: 72,75 %.
- Mediane Anzahl der AK-Läsionen bei Baseline: 6.
- Behandlungsareal: Verhältnis Gesicht zu Kopfhaut: 2:1.
Primäre Ergebnismessgrößen
- Die primäre Ergebnismessgröße war ein 100%iges Abklingen der AK nach 57 Tagen innerhalb des Areals von 25 cm2 bei erwachsenen AK-Patienten mit einer 1%igen KX2-391-Salbe im Vergleich zur Trägersubstanz.
Sekundäre Ergebnismessgrößen
- Die Beurteilung der Sicherheitsdaten hinsichtlich lokaler Hautreaktionen und AEs bei der 1%igen KX2-391-Salbe im Vergleich zur Trägersubstanz bei Erwachsenen mit AK.
Angewendete Arzneimittel/Verfahren
- Bei KX2-391 handelt es sich um eine niedermolekulare Verbindung mit differenzierten Wirkmechanismen, u. a. der Hemmung der Src-Kinaseaktivität und der Hemmung der Tubulin-Polymerisation, die zu einer Hochregulierung der Apoptose in den proliferierenden Zellen führt.
- Das Behandlungsareal umfasste 25 cm2 mit 4–8 typischen, sichtbaren AK-Läsionen im Gesicht oder auf der Kopfhaut.
- 1%ige KX2-391-Salbe im Vergleich zur Trägersubstanz in einem Verhältnis von 1:1.
- Die Behandlung erfolgte einmal täglich an 5 aufeinanderfolgenden Tagen; sie wurde von den Studienteilnehmern aufgetragen und verbliebt dort etwa 12 Stunden.
- Es wurde eine Compliance von über 99 % erreicht.
- Die Ergebnismessgrößen für die Wirksamkeit zeigten einen statistisch signifikanten Effekt bei der Behandlung mit KX2-391 im Vergleich zur Trägersubstanz (Tabelle).
- Entsprechend den Ergebnismessgrößen für die Sicherheit wurde KX2-391 gut vertragen.
- Eine okuläre Exposition führte zu keinen unerwünschten okulären Ereignissen.
- Es gab keine verbundenen, klinisch signifikanten auffälligen EKGs oder Veränderungen in den körperlichen Untersuchungen, Vitalzeichen oder Laborergebnissen.
- Bei keinem der schwerwiegenden unerwünschten Ereignisse (SAEs), die während der Studie auftraten, wurde ein Zusammenhang mit der Behandlung festgestellt.
- Der Anteil der TEAEs war 11–20 % im aktiven Studien-Arm und 9–11 % im Studien-Arm, der nur die Trägersubstanz erhielt.
- Die mittlere kombinierte LSR-Summe von 4 trat nach 8 Tagen ein und war durchschnittlich an Tag 29 abgeklungen. Die häufigsten LSR-Fälle waren Erythem, Schuppen oder Abschilferung.
- Die Sicherheit und Wirksamkeit der 1%igen KX2-391-Salbe wurde in zwei identischen Phase-III-Studien nachgewiesen. Es wurde insgesamt eine höhere Rate des vollständigen Abklingens der AK nach 57 Tagen festgestellt, wobei jeweils 44 % und 54 % der Patienten ein 100%iges Abklingen der AK erzielten.
- Es wurden statistisch signifikante klinische Unterschiede, einschließlich im Gesicht und auf der Kopfhaut, in allen analysierten Subgruppen nachgewiesen.
- Die meisten TEAEs waren leichte bis mittelschwere Fälle von Pruritus oder Schmerzen an der Anwendungsstelle, die nicht behandelt werden mussten.
- Die Compliance der Studienteilnehmer war hervorragend und > 99 % schlossen die 5-tägige Selbstanwendung der Salbe vollständig ab.
Kernaussagen/klinische Perspektiven
- Die Sicherheit und Wirksamkeit der 1%igen KX2-391-Salbe als Behandlung von erwachsenen Patienten mit AK wurde nachgewiesen.
- Bei nahezu der Hälfte (jeweils 44 % und 54 %) kam es zu einem 100%igen Abklingen der AK, wobei eine stärkere Verbesserung im Gesicht beobachtet wurde.
- Laut Sicherheitsergebnissen waren die meisten TEAEs leicht bis mittelschwer und mussten nicht behandelt werden.
Presenter disclosure(s): The presenter has reported that he is an investigator for this clinical trial, and that the study is sponsored by Athenex, Inc. The content of the presentation had not been publicly disclosed as of the AAD 2019 presentation, and was provided for research purposes only. Almirall and Athenex are partners in the development program of KX2-391 ointment 1% for actinic keratosis.
Written by: Daniel Bennett, MPH
Reviewed by: Martina Lambertini, MD
CONFERENCE SUMMARIES

WILLKOMMEN ZU DEN AAD HIGHLIGHTS
Prof. Nellie Konnikov, MD, FAADWir freuen uns, Ihnen die Highlights der Jahrestagung 2019 der American Academy of Dermatology (AAD) vorzustellen. Die Tagung fand vom 1. bis 5. März 2019 in Washington (DC) statt. Zu den Höhepunkten der AAD-Konferenz zählten u. a. … [ MEHR LESEN ]

 amèrica latina
amèrica latina Canada EN
Canada EN Canada FR
Canada FR English
English italiano
italiano português
português Taiwan
Taiwan