RÉSUMÉS
Les inhibiteurs oraux des Janus kinases PF-06700841 et PF-06651600 ont conféré un effet thérapeutique cliniquement évident en 4 et 6 semaines chez des patients atteints d’alopecia areata (pelade) et une efficacité plus grande sur 24 semaines chez les patients dont l’épisode courant de pelade était de plus courte durée : Résultats d’un essai randomisé de phase 2a
Présenté par: Elena Peeva, MD, MSc, FACRCambridge, MA, USA
- Les inhibiteurs oraux des Janus kinases (JAK) PF-06700841 et PF-06651600 ont commencé à agir en 6 semaines chez des patients atteints de pelade.
- Les analyses de sous-groupes montrent que les caractéristiques cliniques de base spécifiques à la durée de l’épisode de pelade ont un impact sur les résultats.
L’inhibiteur oral de la tyrosine kinase 2 (TYK2)/JAK1 PF-06700841 et l’inhibiteur oral de la JAK3 PF-06651600 ont été étudiés dans le cadre de cet essai clinique de phase 2a sur la pelade (alopecia areata, AA) de modérée à grave. Les paramètres spécifiques au moment du début d’action ont été comparés entre les deux traitements et le placebo. Des analyses de sous-groupes selon les caractéristiques cliniques spécifiques au type d’AA et à la durée de l’épisode ont aussi été faites.
- Évaluer le début d’action de l’inhibiteur oral de la TYK2/JAK1 PF-06700841 et de l’inhibiteur oral de la JAK3 PF-06651600 dans l’AA de modérée à grave.
- Évaluer la durée de l’épisode d’AA et son lien avec l’efficacité du PF-06700841 et du PF-06651600 sur 24 semaines.
Type d’étude
- À double insu.
- Randomisée.
- Multicentrique.
- De phase 2a.
- Deux volets de prolongation en cours.
But principal
- Le but principal de l’étude était d’évaluer l’inhibiteur oral de la TYK2/JAK1 PF-06700841 et l’inhibiteur oral de la JAK3 PF-06651600 dans l’AA de modérée à grave.
- On a aussi évalué le moment du début d’action et la durée de l’épisode d’AA.
Populations de patients
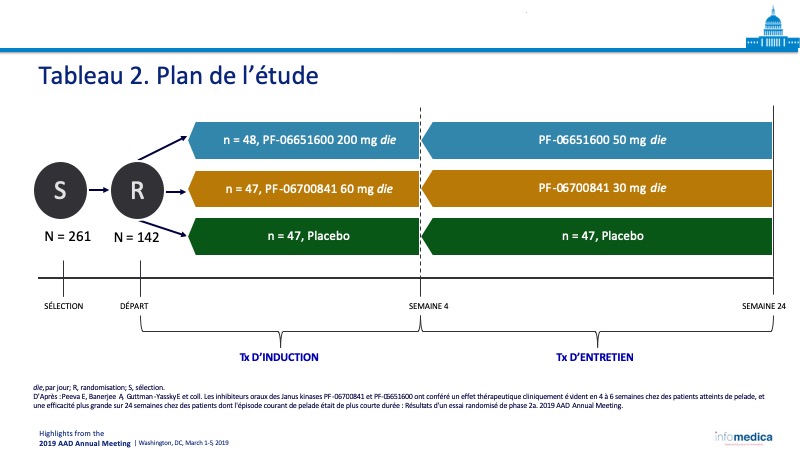
- Nombre total de patients recrutés : 142 patients répartis dans trois cohortes, PF-06700841 (n = 47), PF-06651600 (n = 48) et placebo (n = 47).
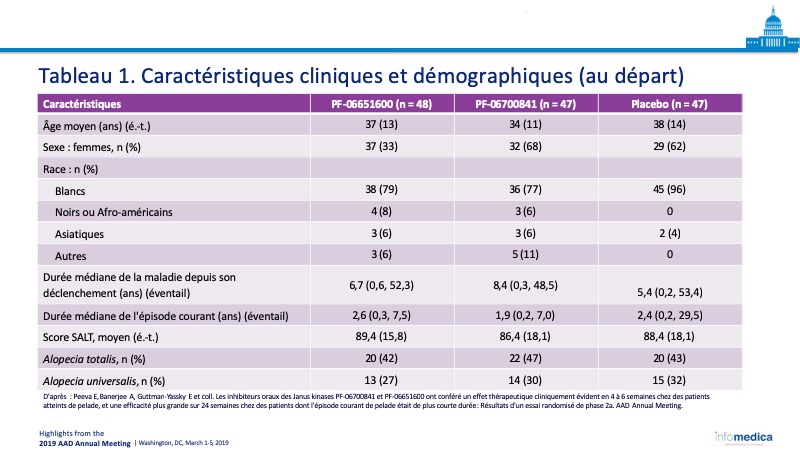
- Âge : patients de 18 à 75 ans dans les trois cohortes, âgés en moyenne de 37 ans, 34 ans et 38 ans, respectivement.
- Population en intention de traiter.
- AA de modérée à grave (perte > 50 % des cheveux).
- Inclut les patients atteints d’alopecia universalis et d’alopecia totalis.
- Au tableau 1, caractéristiques cliniques et démographiques des patients.
Paramètre principal
- Le paramètre principal était le score à l’échelle SALT (Severity of Alopecia Tool), avec une analyse longitudinale des changements par rapport aux valeurs de départ afin d’identifier la première différence statistiquement significative entre le PF-06700841, le PF-06651600 et le placebo.
Paramètres secondaires
- Les paramètres secondaires étaient l’analyse de sous-groupes par l’échelle SALT des changements par rapport aux valeurs de départ entre le PF-06700841, le PF-06651600 et le placebo, et l’impact de la durée de l’épisode courant sur l’efficacité.
Médicaments/interventions utilisés
- Les patients ont été assignés à trois cohortes et traités au moyen du PF-06700841, du PF-06651600 ou d’un placebo pour la durée de l’étude, soit 24 semaines (Tableau 2).
- Les caractéristiques cliniques de départ ont été évaluées, notamment : durée de la maladie depuis son déclenchement; durée de l’épisode courant; score à l’échelle SALT et établissement du diagnostic d’AA, d’alopecia totalis ou d’alopecia universalis.
- Le score SALT a été vérifié régulièrement en lien avec les caractéristiques cliniques, la durée de la maladie et la cohorte de traitement.
- Dans l’alopecia areata de modérée à grave, l’inhibiteur oral de la TYK2/JAK1 PF-06700841 et l’inhibiteur oral de la JAK3 PF-06651600 commencent à agir en 4 et 6 semaines.
- La réponse mesurée à 24 Semaines serait plus marquée chez les participants dont l’épisode courant d’alopecia areata est de plus courte durée au départ.
Messages clés/perspectives cliniques
- Les données de l’essai de phase 2 sur l’inhibiteur oral de la TYK2/JAK1 PF-06700841 et l’inhibiteur oral de la JAK3 PF-06651600 indiquent qu’ils commencent à agir plus tôt que les traitements antérieurs, avec un début d’action dans l’alopecia areata de modérée à grave en 4 et 6 semaines, respectivement.
- Les analyses de sous-groupes selon les caractéristiques cliniques démontrent que la réponse serait plus marquée chez les patients dont la maladie dure depuis moins longtemps.
Presenter disclosure(s): The presenter has reported the following disclosure: Pfizer Inc.
Written by: Daniel Bennett, MPH
Reviewed by: Martina Lambertini, MD
SOMMAIRE

Bienvenue sur AAD 2019
Prof. Nellie Konnikov, MD, FAADNous sommes heureux de vous présenter les faits saillants du Congrès annuel 2019 de l’American Academy of Dermatology (AAD). La rencontre s’est déroulée du 1er au 5 mars 2019 à Washington, DC. Les faits saillants … [ Tout lire ]

 amèrica latina
amèrica latina Canada EN
Canada EN Deutschland
Deutschland English
English italiano
italiano português
português Taiwan
Taiwan