RESÚMENES
ALOPECIA AREATA
Los inhibidores orales de la quinasa Janus, PF-06700841 y PF-06651600, proporcionan un efecto terapéutico clínicamente evi-dente a las 4 y 6 semanas en pacientes con alopecia areata, y ma-yor eficacia a las 24 semanas en pacientes con una duración más corta de su episodio actual de alopecia: resultados de un ensayo clínico aleatorizado de fase 2
Presentado por: Elena Peeva, MD, MSc, FACRCambridge, MA, USA
- Los inhibidores orales de la quinasa Janus (JAK), PF-06700841 y PF-06651600, muestran el inicio del efecto a las 6 semanas en los pacientes con alopecia areata (AA).
- Los análisis por subgrupos muestran que las características clínicas basales correspondientes a la duración del episodio de AA impactan en los resultados
En este ensayo clínico de fase 2 en AA moderada a grave, se estudiaron los inhibidores orales de la tirosina quinasa 2 (TYK2)/JAK1, PF-06700841 y JAK3, PF-06651600. Las medidas de resultado correspondientes al tiempo hasta el inicio del efecto se compararon entre los dos tratamientos y placebo. También se analizaron subgrupos con características clínicas específicas correspondientes al tipo y duración de la AA.
- Evaluar el inicio de acción de los inhibidores orales de TYK2/JAK1, PF-06700841, y de JAK3, PF-06651600, en AA moderada a grave.
- Evaluar la duración del episodio de AA y evaluar la relación entre la eficacia de PF-06700841 y PF-06651600 durante 24 semanas.
Tipo de estudio
- Doble ciego.
- Aleatorizado.
- Multicéntrico.
- Fase 2.
- Dos extensiones en desarrollo.
Objetivo principal
- El objetivo principal del estudio fue evaluar los inhibidores orales de TYK2/JAK1, PF-06700841, y, de JAK3, PF-06651600, en AA moderada a grave.
- Se evaluó el tiempo hasta el inicio del efecto y la duración del episodio de AA.
Población de pacientes
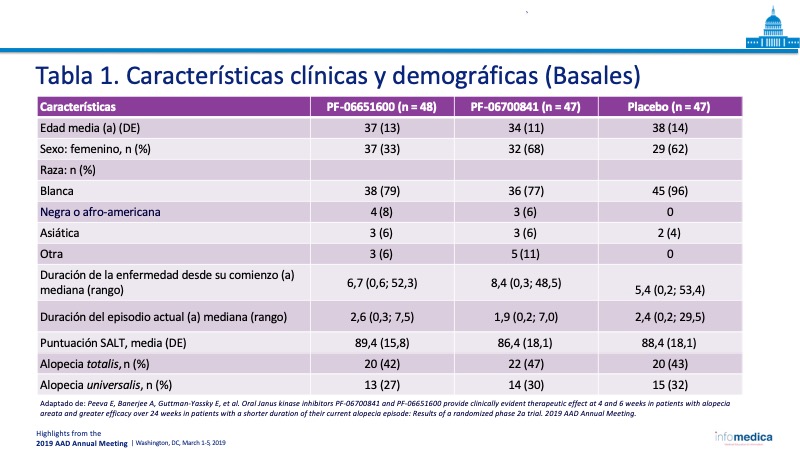
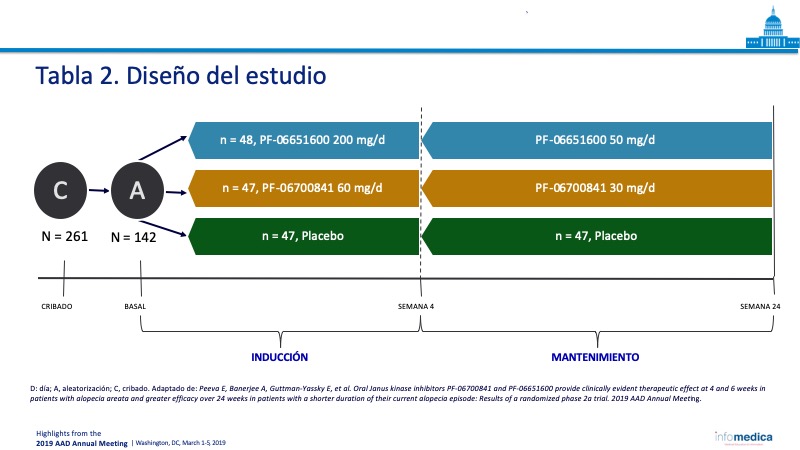
- Número total de reclutados: 142 pacientes en las tres cohortes, PF-06700841 (n = 47), PF-06651600 (n = 48), y placebo (n = 47).
- Edad: pacientes de 18-75 años en las tres cohortes, con una media de 37 años, 34 años y 38 años, respectivamente.
- Población por intención a tratar.
- AA moderada a grave (>50% del cuero cabelludo con pérdida de pelo).
- Incluye pacientes con alopecia totalis y alopecia universalis.
- En la Tabla 1, se muestran las características clínicas y demográficas de los pacientes.
Medida principal de resultado
- La medida principal de resultado fue la puntuación en la herramienta de medida de la gravedad de la alopecia (Severity of Alopecia Tool, SALT), con un análisis longitudinal del cambio desde la determinación basal para identificar la primera diferencia estadísticamente significativa, comparando PF-06700841, PF-06651600 y placebo.
Medida secundaria de resultado
- La medida secundaria de resultado fue el análisis por subgrupos del cambio a lo largo del tiempo en la puntuación SALT desde la determinación basal, comparando PF-06700841, PF-06651600 y placebo para comparar el impacto en la eficacia de la duración del episodio actual de AA.
Fármacos/Procedimientos utilizados
- Los pacientes fueron asignados a tres cohortes y tratados con PF-06700841, PF-06651600 o placebo durante las 24 semanas del estudio. Tabla 2.
- Se evaluaron las características clínicas basales, incluyendo: la duración de la enfermedad desde el inicio; duración del episodio actual de la enfermedad; puntuación SALT; y si el participante tenía AA, alopecia totalis o alopecia universalis.
- La puntuación SALT se evaluó regularmente, estableciendo asociaciones entre las características clínicas, la duración de la enfermedad y el tratamiento de la cohorte.
- Para la medida de resultado correspondiente al cambio en la puntuación SALT, la diferencia media frente a placebo en la semana 4 fue de 7,7 para PF-06700841 y de 2,9 para PF-06651600.
- La diferencia media frente a placebo en la semana 6 fue de 19,6 para PF-06700841 y de 12,6 para PF-06651600.
- El análisis por subgrupos, cuando se estratificó por la duración del episodio, indicó que el cambio en la puntuación SALT a la semana 24 desde el inicio del estudio, en comparación con placebo fue de 53,4 para PF-06700841 y de 42,1 para PF-06651600 para participantes con un episodio actual de AA <3,5 años.
- El cambio en la puntuación SALT a la semana 24 desde el inicio, en comparación con placebo, fue de 39,1 para PF-06700841 y de 22,7 para PF-06651600 para participantes con un episodio actual de AA ≥3.5 años.
- Por lo tanto, la medida de resultado secundaria que evaluó el impacto de la duración del episodio actual de AA en la eficacia indicó que la respuesta a 24 semanas fue mayor en los participantes en quienes el episodio actual de AA fue de menor duración.
- Los inhibidores orales de TYK2/JAK1, PF-06700841, y de JAK3, PF-06651600, inician su efecto en la alopecia areata moderada a grave a las 4 semanas y 6 semanas.
- La respuesta medida a las 24 semanas puede ser mayor en los participantes con determinaciones basales del episodio actual de alopecia areata que es más corto en duración.
Mensajes clave/perspectiva clínica
- Los datos del ensayo de fase 2 para los inhibidores orales de TYK2/JAK1, PF-06700841, y de JAK3, PF-06651600, indican que tienen eficacia antes que los tratamientos previos, y que tienen un inicio del efecto en la alopecia areata moderada a grave a las 4 semanas y 6 semanas, respectivamente.
- Los análisis por subgrupos, basados en características clínicas, demuestran que la respuesta puede ser mayor en los pacientes en los que la enfermedad ha persistido durante menos tiempo.
Presenter disclosure(s): The presenter has reported the following disclosure: Pfizer Inc.
Written by: Daniel Bennett, MPH
Reviewed by: Martina Lambertini, MD
RESÚMENES

Bienvenido a los aspectos destacados de la AAD 2019
Prof. Nellie Konnikov, MD, FAADNos complace presentar los aspectos más destacados de la Reunión Anual de la Academia Americana de Dermatología (AAD) de 2019. Nuestra reunión se llevó a cabo del 1 al 5 de marzo de 2019 en Washington, DC. La conferencia de la AAD … [ Leer más ]
 Canada EN
Canada EN Canada FR
Canada FR Deutschland
Deutschland English
English italiano
italiano português
português Taiwan
Taiwan