ZUSAMMENFASSUNGEN
1%ige topische Clascoteron-Creme: ein neuartiges, topisches, lokales, selektives Antiandrogen – Ergebnisse aus zwei Phase-III-Studien, in denen Kinder und erwachsene Patienten mit fazialer Acne vulgaris behandelt wurden
Vorgetragen von: Adelaide A. Hebert, MD, FAADProfessor, Department of Dermatology
UTHealth McGovern Medical School, Houston, TX, USA
- Clascoteron ist der erste topische Androgenrezeptorinhibitor und ist in zwei Formulierungen erhältlich. Derzeit wird eine 1%ige Creme bei Akne und eine 7,5%ige Lösung bei androgenetischer Alopezie untersucht.
- Es liegen positive Phase-III-Ergebnisse für Akne und positive Phase-II-Ergebnisse für androgenetische Alopezie vor.
- Bei über 1.700 Patienten wurde ein einwandfreies Sicherheitsprofil nachgewiesen.
Bei Clascoteron handelt es sich um einen topischen Androgenrezeptorinhibitor, der derzeit für die Behandlung von Akne untersucht wird. Clascoteron wird von der Haut hydrolysiert und zu Cortexolon-21-Propionat und Cortexolon metabolisiert. Beide Metabolite weisen eine minimale antiandrogene Aktivität und schwache Glukokortikoid-Eigenschaften auf [1,2]. Das Endpräparat Cortexolon weist ein etabliertes Sicherheitsprofil auf [1,2]. Dieser Wirkstoff beeinflusst die Androgenrezeptoren in den Sebozyten und Haarpapillenzellen innerhalb der Haartalgdrüseneinheit der Haut, greift an mehreren, unterschiedlichen Punkten in die Pathogenese der Akne ein und hemmt die nachgelagerte Dihydrotestosteron-stimulierte Signalweiterleitung der Androgenrezeptoren.
- Hauptziel der Studie war die Beurteilung der Wirksamkeit der 1%igen topischen Clascoteron-Creme bei der Behandlung fazialer Acne vulgaris bei erwachsenen und pädiatrischen Populationen.
- In der Studie wurde die prozentuale Verringerung entzündlicher und nicht entzündlicher Gesichtsläsionen über einen Zeitraum von 12 Wochen untersucht.
Art der Studie
- Phase III.
- Randomisiert.
- Doppelblind.
- Trägerkontrolliert.
- Multizentrisch.
- Zwei identische Studien (25 und 26) in 112 Prüfzentren.
Hauptziel
- Hauptziel der Studie war die Beurteilung der Wirksamkeit der 1%igen topischen Clascoteron-Creme bei der Behandlung fazialer Acne vulgaris bei erwachsenen und pädiatrischen Populationen.
- In der Studie wurde die prozentuale Verringerung entzündlicher und nicht entzündlicher Gesichtsläsionen über einen Zeitraum von 12 Wochen untersucht.
Patientenpopulationen
- Anzahl der Teilnehmer insgesamt: 1.440 Patienten.
- Alter: ≥ 9 Jahre.
- Intent-to-Treat-Population.
- Einschlusskriterien:
- 30–75 entzündliche und 30–100 nicht entzündliche Läsionen.
- IGA-5-Punkte-Skala – mittelschwer bis schwer (Grad 3 oder 4).
- Ausschlusskriterien:
- Schwangerschaft, Stillen oder geplante Schwangerschaft während des Studienzeitraums.
- Pathologien oder Zustände der Haut, die die Bewertung der Prüfprodukte beeinträchtigen könnten oder eine beeinträchtigende topische oder systemische Behandlung erforderlich machen.
- Mehr als 2 Knötchen im Gesicht.
- Nodulozystische Akne.
- Erkrankungen, die die Sicherheit der Teilnahme an der Studie für den Teilnehmer nach Einschätzung des Prüfarztes beeinträchtigen würden.
- Derzeitige Aufnahme in eine Studie zu einem Prüfpräparat oder -produkt.
- Erhalt eines Prüfpräparats oder Prüfung mit einem Prüfprodukt in den letzten 30 Tagen vor Behandlungsbeginn (Baseline).
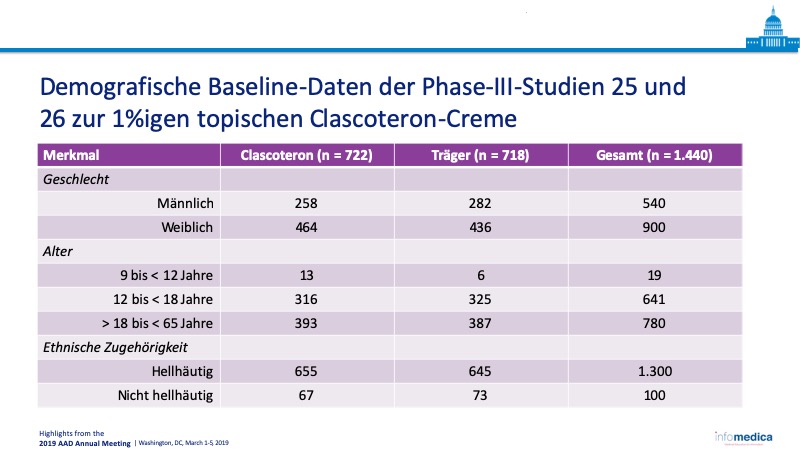
- Tabelle: klinische und demografische Merkmale der Patienten.
Primäre Ergebnismessgrößen
- Die primäre Ergebnismessgröße war die Beurteilung der Veränderung der fazialen Acne vulgaris entsprechend der prozentualen Veränderung der entzündlichen Läsionen nach 12 Wochen, um eine Veränderung gegenüber Baseline zu ermitteln und festzustellen, ob ein statistisch signifikanter Unterschied zwischen der 1%igen topischen Clascoteron-Creme und der Trägersubstanz vorlag.
Sekundäre Ergebnismessgrößen
- Die sekundäre Ergebnismessgröße war die Beurteilung der Veränderung der fazialen Acne vulgaris entsprechend der prozentualen Veränderung der nicht entzündlichen Läsionen nach 12 Wochen, um eine Veränderung gegenüber Baseline zu ermitteln und festzustellen, ob ein statistisch signifikanter Unterschied zwischen der 1%igen topischen Clascoteron-Creme und der Trägersubstanz vorlag.
Angewendete Arzneimittel/Verfahren
- Bei den Studienteilnehmern im Alter von ≥ 9 Jahren mit mittelschwerer bis schwerer Akne wurde eine 12-wöchige Phase-III-Studie, gefolgt von einer 9-monatigen offenen Sicherheitsverlängerungsphase durchgeführt.
- Die Patienten wurden randomisiert (1:1) einer 12-wöchigen Behandlung mit der 1%igen topischen Clascoteron-Creme oder der Creme-Trägersubstanz zugeordnet, in der sie die Creme zweimal täglich, morgens und abends, selbst auftrugen.
- Die beurteilten koprimären Wirksamkeitsendpunkte waren der Anteil der Studienteilnehmer in jedem Arm mit mindestens einer Reduktion im IGA gegenüber Baseline um 2 Punkte und einem IGA-Score von 0 (erscheinungsfrei) oder 1 (nahezu erscheinungsfrei) nach 12 Wochen.
- Die Studienteilnehmer wurden entsprechend der absoluten Veränderung der nicht entzündlichen Läsionen nach 12 Wochen gegenüber Baseline sowie entsprechend der absoluten Veränderung der entzündlichen Läsionen nach 12 Wochen gegenüber Baseline beurteilt.
- Bei der Ergebnismessgröße der nicht entzündlichen Läsionen nach 12 Wochen wies die mit der 1%igen topischen Clascoteron-Creme behandelten Kohorte eine Verringerung um 29,8 % auf, wohingegen bei der Trägersubstanz eine Verringerung um 18,9 % beobachtet wurde, was eine statistisch signifikante Verbesserung darstellt.
- Bei der Ergebnismessgröße der entzündlichen Läsionen nach 12 Wochen wies die mit der 1%igen topischen Clascoteron-Creme behandelten Kohorte eine Verringerung um 46,2 % auf, wohingegen bei der Trägersubstanz eine Verringerung um 32,7 % beobachtet wurde, was eine statistisch signifikante Verbesserung darstellt.
- Während der Behandlung aufgetretene unerwünschte Ereignisse (TEAEs) wurden bei 11,1 % der Clascoteron-Kohorte beobachtet (2,6 % mittelschwer, keine schweren Fälle), im Vergleich zu 12,7 % bei der Trägerkohorte (4,3 % mittelschwer, < 1 % schwer). Lokale Hautreaktionen umfassten leichte Erytheme.
- Die Behandlung mit der 1%igen topischen Clascoteron-Creme führte innerhalb von 12 Wochen sowohl bei Kindern als auch bei Erwachsenen zu einer klinisch signifikanten Verringerung der entzündlichen und nicht entzündlichen Hautläsionen. Ihre Wirksamkeit wurde somit nachgewiesen.
- Die Behandlung mit der 1%igen topischen Clascoteron-Creme ergab eine niedrige Rate an TEAEs, die im Allgemeinen nicht schwer waren. Ihre Sicherheit wurde somit nachgewiesen.
Kernaussagen/klinische Perspektiven
- Die Wirksamkeit der 1%igen topischen Clascoteron-Creme als Behandlung von fazialer Acne vulgaris bei erwachsenen und pädiatrischen Populationen im Alter von ≥ 9 Jahren wird durch die Daten der Phase-III-Studie gestützt.
- Entsprechend den Daten der Phase-III-Studie zur 1%igen topischen Clascoteron-Creme weist sie bei der Behandlung von fazialer Acne vulgaris bei erwachsenen und pädiatrischen Populationen im Alter von ≥ 9 Jahren ein gutes Sicherheitsprofil und hohe Verträglichkeit auf.
REFERENCES
Presenter disclosure(s): The presenter has reported the following disclosures: Allergan, Inc.; Amgen; Anacor Pharmaceuticals, Inc.; Astellas Pharma US, Inc.; Bickel Biotechnology; Cassiopia; Celgene Corporation; Chugai Pharma; Cutanea Life Sciences; US, Department of Defense; Dermavant Sciences; Dermira; Encore Dermatology, Inc.; Galderma Laboratories, L.P.; GlaxoSmithKline; Intendis, Inc.; La Roche-Posay Laboratoire Pharmaceutique; Mayne Pharma Group; Medimetriks Pharmaceuticals, Inc.; Menarini Group; Menlo Therapeutics; Merz Pharmaceuticals, LLC; NIH; Novan; Novartis Pharmaceuticals Corp.; Onset Therapeutics Ortho Dermatologics; Pfizer Inc.; Pharmaderm; PPD Inc.; Prim-Med; Promius Pharma, LLC; Promius Pharmaceuticals; Regeneron; Roivant Sciences; Shionogi USA; Sienna Biopharmaceuticals; Sinclair Pharma; Stiefel, a GSK company; TopMD; Valeant Pharmaceuticals International; Vanda Pharmaceuticals Inc.
Written by: Daniel Bennett, MPH
Reviewed by: Martina Lambertini, MD
CONFERENCE SUMMARIES

WILLKOMMEN ZU DEN AAD HIGHLIGHTS
Prof. Nellie Konnikov, MD, FAADWir freuen uns, Ihnen die Highlights der Jahrestagung 2019 der American Academy of Dermatology (AAD) vorzustellen. Die Tagung fand vom 1. bis 5. März 2019 in Washington (DC) statt. Zu den Höhepunkten der AAD-Konferenz zählten u. a. … [ MEHR LESEN ]

 amèrica latina
amèrica latina Canada EN
Canada EN Canada FR
Canada FR English
English italiano
italiano português
português Taiwan
Taiwan